-
咨询热线:0415-3458366
- 给我留言

 2024-02-02
2024-02-02自1971年第一台 CT 系统问世以来(参见XI区:回望:CT五十年(1968-2018)),临床 CT 系统一直使用闪烁体能量积分探测器(EID),该探测器采用两步检测过程。首先,将 X 射线能量转换为可见光,然后将可见光转换为电信号。科学家对使用能量分辨光子计数探测器(PCD)的一步式直接 X 射线转换过程进行了详细研究。随后,首个临床 PCD-CT 系统于 2021 年投入商业使用。与 EID 相比,PCD 具有更好的空间分辨率、更高的对比噪声比、消除电子噪声、提高剂量效率和常规多能量成像。本文将从技术上介绍 PCD 在 CT 成像中的应用,并介绍其优点、局限性和潜在的技术改进。
能量分辨光子计数探测器技术简介
能量分辨光子计数探测器(PCD)的典型设置如图1所示。探测器的核心是由碲化镉(CdTe)、碲化镉锌(CZT)或硅制成的半导体层。X射线穿过患者后,被这层半导体吸收并产生电荷云,在探测器顶部阴极和底部像素化阳极电极之间的高电压(800-1000V)产生的强电场中,电荷云被分离。电子移动到阳极,产生短电流脉冲。脉冲整形电路将电流脉冲转换为电压脉冲,最大信号的一半宽度为10-15 ns。电压脉冲的振幅与吸收的能量成正比。当脉冲高度超过阈值时,就会对脉冲进行电子计数。PCD还可在多个电压阈值下运行,以提供能量分辨数据。
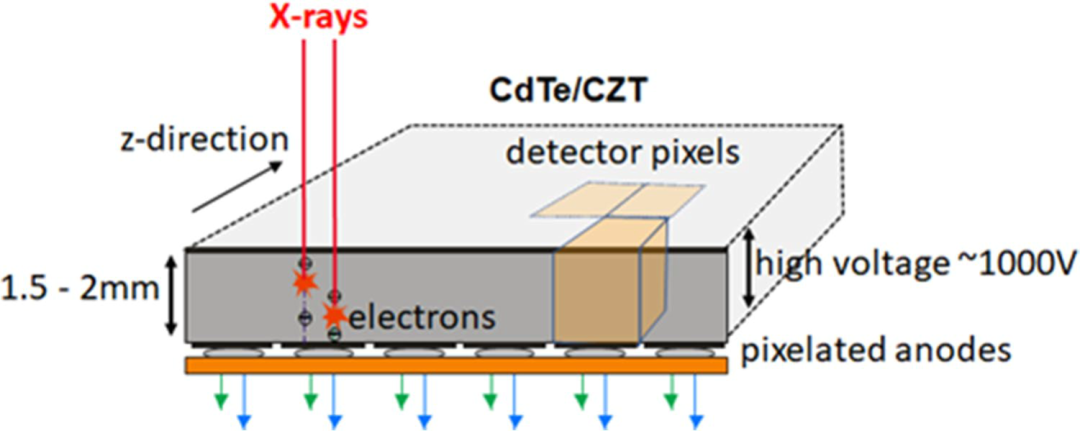
与目前医用CT系统中使用的固态闪烁探测器相比,PCD具有多项优势。在能量积分探测器中,X射线光子的能量首先转化为可见光,然后产生电流。单个探测器元件必须由反射格栅隔开,以防止光学串扰。
这些格栅会降低探测器的几何剂量效率,因为其中吸收的X射线量子不会对测量信号产生影响。为了将这些死区造成的损耗保持在可接受的水平,有源探测器元件不能变得越来越小,这最终限制了能量积分探测器所能达到的空间分辨率。而能量分辨光子计数探测器则不需要单个像素之间的间隔,因此可以做得更小。几何剂量效率只会因反散射格栅而降低,而反散射格栅对于之前所有的CT探测器都是必要的。当探测器的像素非常小(例如投射到等中心时小于0.2mm)时,就不必在每个探测器元件之间设置反散射格栅。因此,PCD的分辨率可达40 lp/cm以上,而能量积分探测器的最高分辨率为20 lp/cm。更高的空间分辨率为骨骼结构、肺部和小血管的CT检查提供了显著的临床优势,前提是噪声的增加得到充分解决。
在能量分辨PCD中,吸收的X射线产生的所有脉冲一旦超过代表光子能量T0的阈值电压就会被计数,阈值电压的值通常约为20-25keV。电子噪声的振幅很低,远远低于这个阈值。因此,电子噪声不会导致计数,即使在剂量很低的情况下,此时统计泊松噪声是主要的噪声源。因此,与使用能量积分探测器的相应扫描相比,辐射剂量极低的CT扫描或肥胖病人的CT扫描具有更低的图像噪声、更少的条纹伪影和更稳定的CT值,辐射剂量的降低似乎有可能超过目前的限制。
所有X射线量子对探测器信号的贡献权重相等,而不论其能量E大小。低能量量子基本上决定了CT图像中不同组织之间的对比度。在使用碘造影剂扫描时,PCD的吸收率特别高,刚好高于其33keV的K-edge,因此能生成碘对比噪声比更高的CT图像。这可以减少辐射剂量或造影剂用量。
能量分辨PCD可使用多个阈值能量。图2展示了同时采集两个测量信号的过程,其中检测到的量子能量超过了阈值T0和T1。将相邻能量阈值的探测器信号相减,就会产生"能量仓"数据,其中包含能量在两个阈值之间的所有X射线计数。对CT数据进行能量分辨测量,可在任何CT扫描中进行多能量材料分辨。所有已建立的双能量应用都可以使用两个能量仓。使用三个或更多能量仓采集数据可区分两种造影剂(碘和另一种K-edge大于40 keV的材料,如钆或金)。
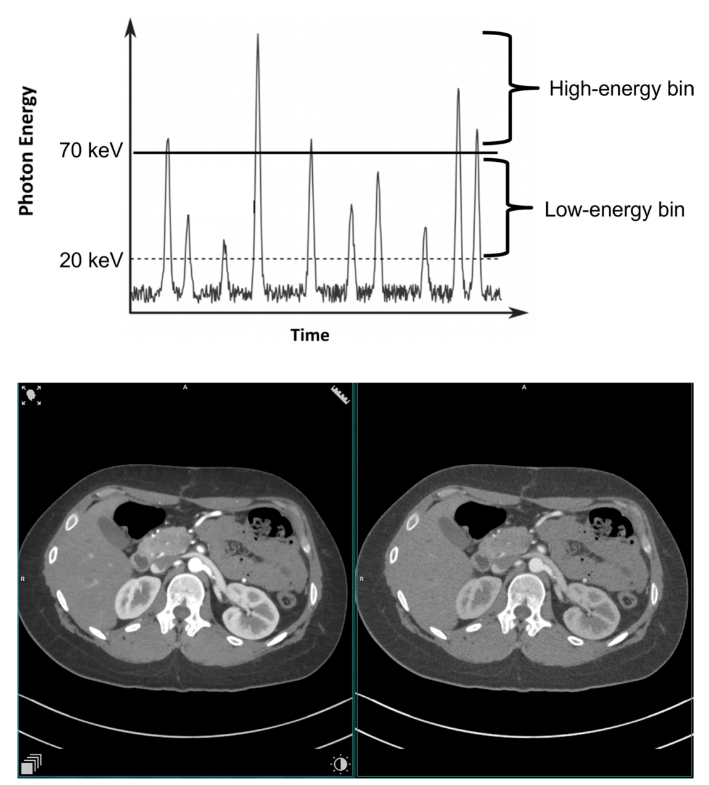
图2 在两个阈值能量(T0=20 keV,T1=70 keV)下采集数据的示意图,提供两个光谱分辨探测器信号。下图是一名25岁女性的腹部增强扫描图,该扫描图是用临床光子计数CT原型机在上述两个阈值能量下获得的
PCD的物理限制
由低原子序数Z材料(如硅)制成的探测器与由高Z材料制成的探测器相比,光电吸收减少,探测器内的康普顿散射量增加。在探测器中发生康普顿散射的X射线会丢失有关原始相互作用位置的信息,从而导致生成图像的清晰度下降。一些散射光子也会离开探测器,不会对测量信号产生影响,从而导致剂量效率降低。
对于高Z值探测器(如碲化镉或CZT)来说,探测器中几乎不存在康普顿散射,大多数光子通过光电效应直接被吸收。然而,有两种效应会导致信息丢失:首先,光电效应会导致电子从探测器材料原子的内部电子壳(通常是K壳)中射出。当电子空位被填满时,原子可能会发射出特征光子,从而将部分入射能量带出探测器像素。这就是所谓的K逃逸。其次,如果入射X射线光子的吸收发生在靠近像素边界的地方,那么所产生的电荷云可能会在相邻的两个像素之间分裂。这被称为电荷共享。因此,单个高能X射线光子可能会被错误地计算为多个低能光子。例如,一个80-keV的光子可能在一个像素中显示为50-keV的光子,而在下一个像素中则显示为30-keV的光子。这会导致测量的X射线光谱失真,影响多能量应用。
像素越大,电荷共享和K逃逸对探测器信号的相对贡献就越小,但脉冲堆积的影响就越大。在高X射线通量下(CT系统在低衰减区域通常会产生高达109光子/秒/mm2的X射线),X射线击中探测器像素的速度太快,无法单独记录。能量过高时,多个重叠的脉冲会被算作一个光子相互作用。这被称为脉冲堆积。脉冲堆积会导致非线性计数率,最终导致探测器饱和。减少脉冲堆积的一种方法是使用较小的探测器像素,但K逃逸和电荷共享的影响会随之增加。另一种方法是使用edge-on的硅基PCD,因为它们具有更高的电荷载流子迁移率,可以处理更高的X射线通量,而不会出现脉冲堆积。
实现临床PCD-CT所面临的挑战
探测器材料(如碲化镉、CZT、硅)的高产能制造
碲化镉作为探测器材料的研究始于20世纪50年代。该材料群最有趣的特性是对多种辐射的敏感性。人们的主要兴趣集中在红外、X 射线和 γ 射线辐射探测器领域。碲化镉的商业潜力巨大,但碲化镉尤其是碲锌镉的晶体质量是一个限制因素。大多数应用所需的高电阻率 (ρ > 109 Ω·cm) CdTe 和 (ρ > 1010 Ω·cm) CdZnTe 的生长相当复杂。Acrorad 公司从碲溶剂中生长碲化镉(CdTe)和 Redlen 公司生长碲镉锌(CdZnTe)的方法(称为 "移动加热器法"(THM))取得了突破性进展。移动加热器法基于从溶剂区生长CdTe和CdZnTe,具有生长温度较低的优点。由于其优势,特别是在碲化镉晶体生长方面,移动加热器法现已成为高产生产这些材料的首选方法。然而,这仍然是一项复杂的技术,而且生长速度相当缓慢。THM 可产生直径达 3 英寸(75 mm)的两种材料的单晶体。碲化镉和碲锌镉之间的差异与电荷载流子的电阻率和迁移率-寿命有关。目前有几家公司正在通过 THM 法生产探测器级碲化镉和碲锌镉,如 Eurorad、Acrorad、EV Products Kromek和 Redlen。高电阻率晶体的生长是一项复杂的挑战。
2016年出现了用于直接转换半导体读出的专用集成电路。在像素尺寸的选择上有一个有趣的权衡:使用较小的像素尺寸可以处理较高的光子通量,因为单个像素每次看到的光子较少。这样可以最大限度地减少脉冲堆积。小像素的另一个优势是,像素越小,脉冲越短,从而提高探测器的高通量能力。这就是所谓的小像素效应。另一方面,小像素尺寸会增加电荷共享和K逃逸,从而扭曲光谱响应。开发读出ASIC所面临的主要挑战是如何满足相互矛盾的要求,尽可能降低电子噪声和功耗。
PCD开发和早期系统台式系统和小动物模型系统PCD的早期评估是使用小动物模型扫描仪和台式系统进行的。据报道,临床前研究使用了配备硅、碲化镉、CZT和砷化镓PCD的研究系统,这些系统具有2至8个能量箱,探测器像素尺寸小至55 μm,以便及早了解这种探测器技术的临床潜力。例如,利用这些系统对小鼠和兔子模型进行了小动物研究,以研究使用金纳米粒子对易受损伤的动脉粥样硬化斑块进行材料特异性成像,以及基于脂质体碘的渗透性和保留性增强进行肿瘤分化。这些系统还有助于扫描体外人体组织,如动脉粥样硬化斑块的动脉段或造影剂增强的软骨标本。此外,还利用台式系统对光谱失真、电荷共享和脉冲堆积效应等物理概念进行了评估。
临床前系统
GE医疗
GE Healthcare使用DxRay开发的碲化镉PCD取代GE VCT扫描仪上的传统能量积分探测器(EID),开发了全视场PCD-CT扫描仪原型。该探测器有2个能量分区,计数率能力相当有限,仅为5×106计数/秒/ mm2。探测器像素为1×1 mm2,配置为二维多切片几何结构,探测器像素为1000×32(32层CT系统)。该系统后来安装在以色列拉宾医疗中心,并进行了一些人体扫描,包括颈动脉血管造影和腹部检查,使用的管电流(例如腹部扫描使用140 mA、140 kV、1 s旋转速度)比常规临床检查使用的管电流相对较低。PCD CT扫描仪可生成各种类型的双能量图像,包括虚拟单色图像、碘图、原子序数(Z)图和虚拟平扫图像。通用电气公司(GE)已制造出使用硅基探测器Edge-on阵列的全尺寸CT系统,该系统正在进行早期患者研究。
西门子医疗
西门子医疗集团(Siemens Healthineers)利用其第二代双源CT系统(SOMATOM Definition Flash)制造了一套全身研究型PCD-CT系统(SOMATOM CounT),将两个探测器阵列中的一个换成了碲化镉PCD。PCD阵列有32排0.9 mm × 0.9 mm的探测器宏像素,相当于等中心0.5 mm × 0.5 mm。
每个宏像素包含4×4个正方形子像素,大小为0.225 × 0.225 mm2。可以使用宏像素(4×4子像素)或超高分辨率(UHR)模式(2×2子像素)获取数据,超高分辨率模式的有效探测器尺寸为等中心0.25 × 0.25 mm2。每个探测器配置有2个能量阈值,使用特殊的"chess"模式可获得4个能量阈值,该模式每隔一个宏像素就以不同的能量阈值运行,从而形成类似国际象棋棋盘的4个能量阈值分布。PCD阵列的视场(FOV)为275 mm,而EID系统的视场为500 mm。对于大于275 mm的物体,需要进行低剂量数据完成扫描,以避免截断伪影。该系统的一个重要特点是,它可以使用高达550 mA的管电流进行高通量扫描,这足以满足大多数全身扫描的需要,与商用EID-CT扫描仪提供的管电流相当。三个医疗中心(梅奥诊所、美国国立卫生研究院和德国癌症中心)都安装了该设备,并对这些系统进行了广泛的患者研究,结果表明PCD-CT与EID-CT相比具有多种优势,包括空间分辨率更高(150 μm)、辐射剂量更低、图像伪影更少,以及可同时进行高分辨率、多能量成像。
后来,西门子医疗集团制造了单源PCD-CT研究系统(SOMATOM Count Plus),该系统的PCD阵列具有500 mm的全视场。这种FOV和Z轴覆盖范围与商用EID扫描仪相当,而且无需数据完成扫描。PCD阵列由0.275×0.322 mm2的子像素组成,相当于等中心的0.151×0.176 mm2。由于准直器叶片的存在,UHR模式的有效最小重建层厚为0.2mm,多能模式为0.4mm。同一制造商生产的商用双源PCD CT(NAEOTOM Alpha)也采用了类似的探测器配置。
飞利浦医疗
飞利浦公司制造了一个光谱光子计数CT(SPCCT)系统原型,并安装在法国里昂平民医院。该系统基于制造商的一个EID平台(iCT),使用2 mm厚的CZT PCD和ChromAIX2 ASIC。在高分辨率模式下,每个像素有5个能量阈值,探测器间距为等中心0.274×0.274 mm2。该系统具有完整的50 cm FOV和64×0.275mm(17.6mm)Z轴覆盖范围。目前已使用该系统进行了患者研究,以调查在心脏和肺部成像等不同领域的临床优势。
PCD-CT优点的早期证据
无电子噪声
在低剂量检查中,EID产生的电子噪声会在重建图像中转化为条纹伪影和CT值不稳定性。电子噪声和相关伪影的存在限制了在肺癌筛查等低剂量检查中使用EID-CT系统所能达到的剂量降低程度。在PCD中可以通过能量阈值消除电子噪声的影响。
当最低能量阈值被设定为高于低幅电子噪声水平时,真实的X射线计数就能从电子噪声中分离出来(图2,顶部),从而减少伪影,并在较低辐射剂量下提高CT值的稳定性(图3)。
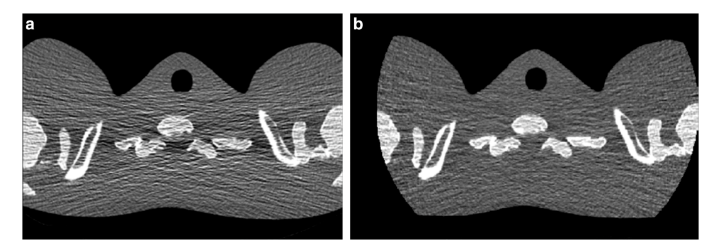
图3 在低光子通量条件下通过EID(a)和PCD(b)原型获得的拟人肩部模型图像。与EID图像相比,PCD图像的水平条纹伪影明显减少,整体外观更加均匀。
增强图像对比度
低能量X射线(如小于40-50 keV)具有显著的组织对比度信息,尤其是来自碘和骨骼的信息。然而,与高能量X射线相比,EID在这些低能量下产生的信号值较低。不幸的是,高能量光子几乎不携带组织对比信息,却能产生最多的信号。由于PCD会对每个光子进行计数,并将其分配到各个能量箱中,因此所有光子的权重都相同,与能量无关。因此,相对于EID,低能量光子对PCD的贡献更大,从而改善了图像对比度和对比噪声比(图4)。除了这一基本优势外,由于X射线是根据其能量进行分档的,因此用户可以在采集后为各个能量分档分配自定义权重,从而提高图像对比度。
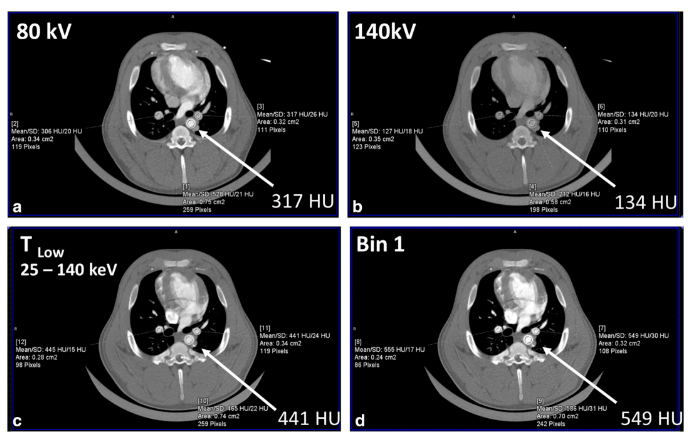
图4 上图是在80 kV和140 kV电压下扫描的猪的EID-CT图像,显示在较高的管电压下碘对比度大幅下降。下图是在140 kV电压下扫描的同一动物的PCD-CT图像。在低能量阈值图像(TLow)中,主动脉中的碘信号(箭头)更高,该图像包含25到140 keV的光子。包含25至65 keV光子的1号仓图像具有最高的碘信号,甚至比EID-CT系统在80 kV电压下获得的碘信号更亮。
探测器像素更小
EID像素之间的光学反射格栅可减轻相邻像素之间的光学串扰。有限大小的像素间反射格栅会导致EID像素之间出现死区,从而导致几何剂量效率低下。由于PCD不会产生可见光,因此不需要像素间的格栅。因此,可以使用非常小的探测器像素(例如等中心150 μm),而不会影响几何剂量效率。
一些文献报道已经证明了PCD-CT提高空间分辨率的临床优势。除了更高的空间分辨率外,较小PCD像素的更精细探测器采样也可用于降低图像噪声。使用检测器采样更精细的PCD阵列采集数据时,如果CT图像的重建图像清晰度(即重建卷积核)比系统的最大空间分辨率更平滑,就能降低图像噪声(图5)。另外,还可以利用降噪优势,在固定目标图像噪声的情况下减少辐射剂量。
PCD空间分辨率的提高要求使用更小的图像体素来充分表达提高的分辨率。如图5所示,在噪声和剂量水平与EID-CT相近的情况下,可以做到这一点。但是,对于空间分辨率非常高的图像(例如各向同性分辨率为0.2-0.25 mm)来说,噪声会增加,因此需要采取迭代重建或深度学习去噪等措施来控制图像噪声。
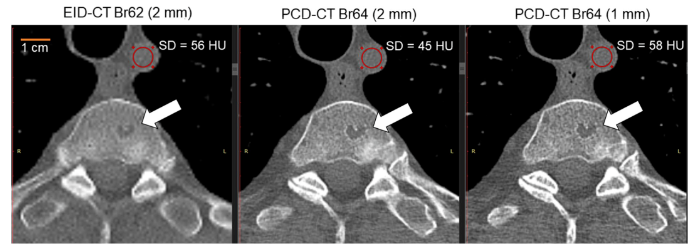
图5 一名74岁男性因多发性骨髓瘤接受全身低剂量CT骨骼检查时的轴向图像。EID-CT图像(左)和高空间分辨率PCD-CT图像(中)是使用相同的辐射剂量(4.2mGy)、层厚(2mm)、几乎相同的重建卷积核(B62和B64)和矩阵大小(512)获得的。与其他匹配的EID-CT图像(左)相比,PCD-CT 2mm图像(中)的噪声低20%(白色圆形感兴趣区内为56 HU对45 HU)。这是PCD系统内在分辨率较高的结果。PCD-CT采用更薄(1mm)的层厚(右图)和1024×1024矩阵,提高了空间分辨率,但图像噪声与EID-CT图像相似。可以看到椎体病变(箭头)的轮廓更加清晰。因此,与EID-CT相比,PCD-CT分辨率的提高可能不需要增加患者剂量就能达到相同的图像噪声水平。
多能量成像
由于PCD-CT系统的每个探测器像素都配备了专用电子设备,可根据各自的能量对X射线光子进行计数和分选,因此可在恒定管电压下获取多能量(光谱)数据。与传统的基于双源或kV快速切换的双能量CT相比,这是一个根本性的优势,因为传统的双能量CT需要两个不同的电压光谱来获取光谱CT数据。因此,PCD-CT可在单管电压下对所有检查类型进行高分辨率的光谱采集。这样就可以常规生成虚拟单色图像、虚拟去钙或虚拟平扫图像以及碘图。
未来技术方向
重合计数
理想的PCD会在原始撞击位置记录每个光子的真实能量。然而,电荷共享和K逃逸等物理机制会导致能量从原始撞击位置扩散到相邻的探测器像素。有人提出了将同时到达相邻像素的信号相加的方案,将信号之和归于贡献最大的像素。
这种"电荷相加"方案已在Medipix3原型探测器中实施。这种方法的主要缺点是需要大量的模拟像素间通信,大大增加了死区时间,因此对于CT等高通量应用来说速度太慢。
由Hsieh开创的另一种方法需要记录相邻像素同时出现的计数。这种"巧合计数"方案的主要简化之处在于,它不需要在像素之间进行任何模拟通信,从而避免了死区时间的增加或堆积。在这些额外的重合计数器中记录的计数可用于校正因电荷共享或K逃逸而扭曲的计数。在最简单的形式中,两个相邻像素中低能量区的两个计数将被其中一个像素中高能量区的一个计数所取代。只要计数率不高,不会导致相邻探测器中两个或多个近乎同时出现的计数被误认为是一个"电荷共享"计数,这种方法就能奏效。图6展示了光谱响应的改进结果。这种简单的机制既成功地消除了40和65 keV之间的低频重复计数峰,又大大减少了在低频区记录的高能光子数量。
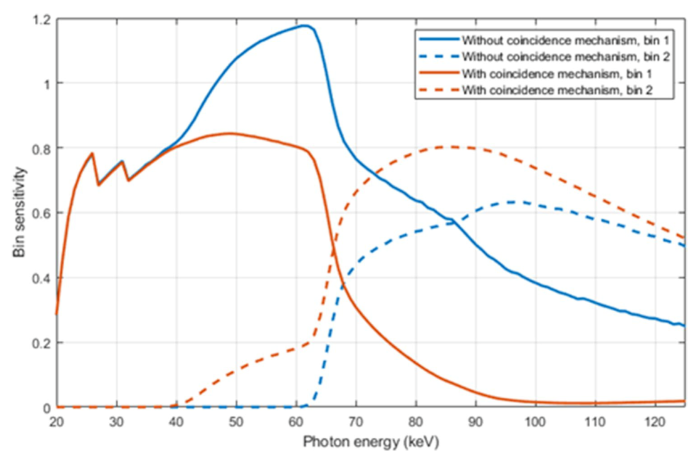
图6 作为输入光子能量函数的碲化镉光子计数探测器的比邻灵敏度(每个进入光子的计数),像素尺寸300 μm,阈值20和65 keV。蓝线显示的是没有任何巧合计数机制的灵敏度。棕色线条显示的是包含简单巧合计数机制的探测器的响应,在这种机制下,两个相邻像素的低能量区中的两个计数被其中一个像素的高能量区中的一个计数所取代。
结论
PCD-CT与传统的EID-CT系统相比,具有许多技术优势,因为它的X射线探测方法与传统的EID-CT系统截然不同。早期对能量分辨PCD的研究前景广阔,如今已将临床PCD-CT系统推向顶峰,其显著的技术特点包括空间分辨率更高、对比噪声比改善、辐射剂量效率提高以及多能量功能的常规可用性,可大大提高CT诊断能力。PCD-CT的出现也促使人们开始利用纳米粒子对多重对比成像和功能成像进行早期研究。